Intramolekulare Wasserstoffbrücken in Hydroxysäuren.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Hydroxysäuren. |
|
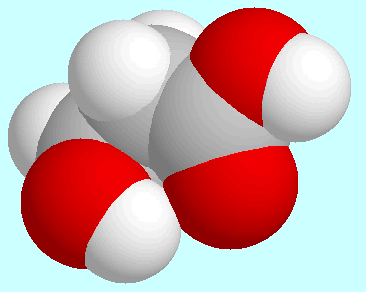
 -Hydroxypropionsäure
bildet im wesentlichen dieselben intramolekularen Wechselwirkungen aus
wie Hydroxyessigsäure: O-H···O=C,
O-H···(CO)O-H und (CO)O-H···O-H.
Die erste dieser Wechselwirkungen tritt im globalen Minimum auf,
dessen Geometrie neben diesem Absatz gezeigt ist. Die COOH-Gruppe liegt
in diesem Konformer in der Ebene der drei Kohlenstoffatome, die aliphatische
OH-Gruppe steht aus dieser Ebene heraus und ist zum Carbonylsauerstoffatom
hin orientiert. In der daraus resultierenden
O-H···O=C-Wechselwirkung
beträgt der H···O-Abstand 2,30 Å
und ist damit etwas länger
als im vergleichbaren Konformer der Hydroxyessigsäure.
Auf Grund der Elektronendichte ist diese Wechselwirkung
keine Wasserstoffbrückenbindung, sondern elektrostatischer Natur.
-Hydroxypropionsäure
bildet im wesentlichen dieselben intramolekularen Wechselwirkungen aus
wie Hydroxyessigsäure: O-H···O=C,
O-H···(CO)O-H und (CO)O-H···O-H.
Die erste dieser Wechselwirkungen tritt im globalen Minimum auf,
dessen Geometrie neben diesem Absatz gezeigt ist. Die COOH-Gruppe liegt
in diesem Konformer in der Ebene der drei Kohlenstoffatome, die aliphatische
OH-Gruppe steht aus dieser Ebene heraus und ist zum Carbonylsauerstoffatom
hin orientiert. In der daraus resultierenden
O-H···O=C-Wechselwirkung
beträgt der H···O-Abstand 2,30 Å
und ist damit etwas länger
als im vergleichbaren Konformer der Hydroxyessigsäure.
Auf Grund der Elektronendichte ist diese Wechselwirkung
keine Wasserstoffbrückenbindung, sondern elektrostatischer Natur.
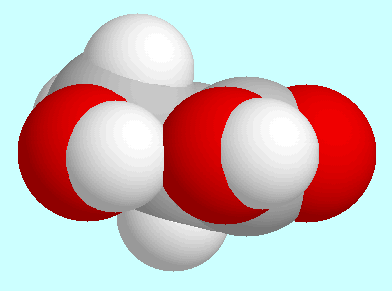 Im energetisch zweitniedrigsten Konformer, das neben diesem Absatz
dargestellt ist, sind COOH- und aliphatische OH-Gruppe koplanar
angeordnet, die Kohlenstoffatome
Im energetisch zweitniedrigsten Konformer, das neben diesem Absatz
dargestellt ist, sind COOH- und aliphatische OH-Gruppe koplanar
angeordnet, die Kohlenstoffatome  und
und  liegen ober- bzw.
unterhalb dieser Ebene. Die O-H···O-H-Wechselwirkung
in diesem Konformer ist eine echte
Wasserstoffbrückenbindung, die allerdings
mit einem H···O-Abstand von 2,15 Å
und einer Bindungsordnung von 0,023 sehr schwach ist. Deshalb erfolgt durch sie
auch keine nennenswerte Stabilisierung:
die relative Energie dieses Konformeren beträgt 7,2 kJ/mol.
liegen ober- bzw.
unterhalb dieser Ebene. Die O-H···O-H-Wechselwirkung
in diesem Konformer ist eine echte
Wasserstoffbrückenbindung, die allerdings
mit einem H···O-Abstand von 2,15 Å
und einer Bindungsordnung von 0,023 sehr schwach ist. Deshalb erfolgt durch sie
auch keine nennenswerte Stabilisierung:
die relative Energie dieses Konformeren beträgt 7,2 kJ/mol.
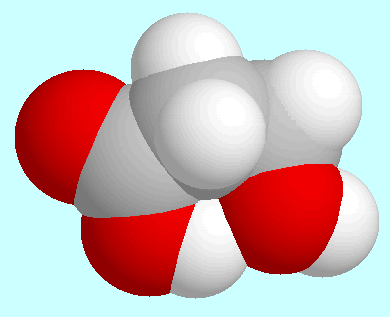 Die (CO)O-H···O-H-Wechselwirkung ist eine
wesentlich stärkere Wasserstoffbrückenbindung mit einer
Bindungsordnung von 0,062 und einem
H···O-Abstand von 1,84 Å; dieser
Wert liegt deutlich
unter dem des entsprechenden Konformeren der Hydroxyessigsäure
(1,97 Å). Obwohl dies auf eine Verstärkung der
Wasserstoffbrücke hindeuten würde, ist die kinetische Stabilität
geringer als im Hydroxyessigsäure-Analogen: die kleinste Potenzialbarriere
beträgt 27 kJ/mol und ist in zwei verschiedenen Reaktionswegen
(mit fast dem gleichen Wert) zu finden. Der eine Reaktionsweg
entspricht der Umwandlung dieses Konformeren in sein Spiegelbild, der zweite
einer kombinierten Drehung der COOH- und der aliphatischen OH-Gruppe
zu einem Konformer, das bis auf die trans-Orientierung der
COOH-Gruppe dem globalen Minimum gleicht.
Innerhalb der Potenzialfläche von
Die (CO)O-H···O-H-Wechselwirkung ist eine
wesentlich stärkere Wasserstoffbrückenbindung mit einer
Bindungsordnung von 0,062 und einem
H···O-Abstand von 1,84 Å; dieser
Wert liegt deutlich
unter dem des entsprechenden Konformeren der Hydroxyessigsäure
(1,97 Å). Obwohl dies auf eine Verstärkung der
Wasserstoffbrücke hindeuten würde, ist die kinetische Stabilität
geringer als im Hydroxyessigsäure-Analogen: die kleinste Potenzialbarriere
beträgt 27 kJ/mol und ist in zwei verschiedenen Reaktionswegen
(mit fast dem gleichen Wert) zu finden. Der eine Reaktionsweg
entspricht der Umwandlung dieses Konformeren in sein Spiegelbild, der zweite
einer kombinierten Drehung der COOH- und der aliphatischen OH-Gruppe
zu einem Konformer, das bis auf die trans-Orientierung der
COOH-Gruppe dem globalen Minimum gleicht.
Innerhalb der Potenzialfläche von 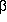 -Hydroxypropionsäure gibt es
sieben symmetrie-eindeutige Konformere, die eine niedrigere Energie haben als
das gegenständliche Konformer (Erel=16,7 kJ/mol),
was ebenfalls für eine geringere
Stabilisierung durch die Wasserstoffbrücke spricht. Eine numerische
Abschätzung bestätigt dies: sie ergibt eine Stabilisierungsenergie
durch die Wasserstoffbrücke
von 36,6 kJ/mol für
-Hydroxypropionsäure gibt es
sieben symmetrie-eindeutige Konformere, die eine niedrigere Energie haben als
das gegenständliche Konformer (Erel=16,7 kJ/mol),
was ebenfalls für eine geringere
Stabilisierung durch die Wasserstoffbrücke spricht. Eine numerische
Abschätzung bestätigt dies: sie ergibt eine Stabilisierungsenergie
durch die Wasserstoffbrücke
von 36,6 kJ/mol für 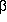 -Hydroxypropionsäure,
aber 54,4 kJ/mol für Hydroxyessigsäure.
-Hydroxypropionsäure,
aber 54,4 kJ/mol für Hydroxyessigsäure.
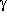 -Hydroxybuttersäure.
-Hydroxybuttersäure.