Intramolekulare Wasserstoffbrücken in Aminoalkoholen.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Aminoalkoholen. |
|
Sowohl  -Amino-n-alkanole als auch
-Amino-n-alkanole als auch
 -Aminosäuren
bilden intramolekulare
Wasserstoffbrücken N···H-O, die deutlich
stärker sind als
alle anderen intramolekularen Wechselwirkungen in diesen Verbindungen.
Der direkte Vergleich, der in den folgenden Abbildungen an Hand eines
Kriteriums für Wasserstoffbrücken vorgenommen ist, zeigt dass
diese Bindung in den Aminosäuren wesentlich stärker ist.
Er zeigt ferner, dass die verschiedenen Kriterien für die
Stärke dieser Wasserstoffbrücke in beiden Fällen nur bis zur
C
-Aminosäuren
bilden intramolekulare
Wasserstoffbrücken N···H-O, die deutlich
stärker sind als
alle anderen intramolekularen Wechselwirkungen in diesen Verbindungen.
Der direkte Vergleich, der in den folgenden Abbildungen an Hand eines
Kriteriums für Wasserstoffbrücken vorgenommen ist, zeigt dass
diese Bindung in den Aminosäuren wesentlich stärker ist.
Er zeigt ferner, dass die verschiedenen Kriterien für die
Stärke dieser Wasserstoffbrücke in beiden Fällen nur bis zur
C -Verbindung konsistente Reihungen ergeben.
-Verbindung konsistente Reihungen ergeben.
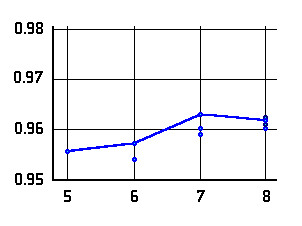
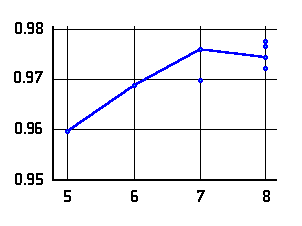
O-H Abstände (Å) in  -Aminoalkoholen (links bzw. oben)
und
-Aminoalkoholen (links bzw. oben)
und  -Aminosäuren (rechts bzw. unten) mit N···H-O Wasserstoffbrücke als
Funktion der Ringgröße. Die Verbindungslinien kennzeichnen
die Konformere niedrigster Energie.
-Aminosäuren (rechts bzw. unten) mit N···H-O Wasserstoffbrücke als
Funktion der Ringgröße. Die Verbindungslinien kennzeichnen
die Konformere niedrigster Energie.
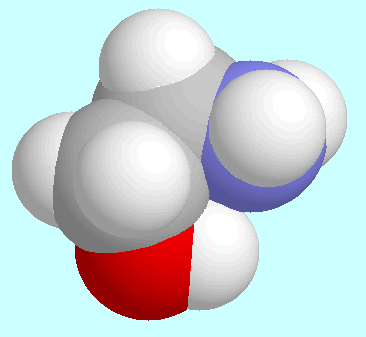
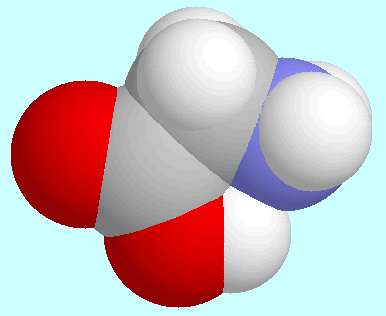 Eine andere Art von Ähnlichkeit bzw. Unterschieden zwischen
Eine andere Art von Ähnlichkeit bzw. Unterschieden zwischen
 -Aminosäuren und
-Aminosäuren und
 -Aminoalkoholen betrifft die Anzahl
und die Geometrie der Konformere mit N···H-O
Wasserstoffbrücke. Sowohl
2-Aminoethanol als auch Glycin bilden je ein symmetrie-eindeutiges
Konformer; dieses ist im ersteren Fall asymmetrisch, aber de facto
symmetrisch im zweiteren. Die Potenzialfläche von 2-Aminoethanol
enthält zwei energetisch äquivalente Reaktionswege, die das
wasserstoffbrückengebundene Konformer mit seinem Enantiomer verbinden
und gleichzeitig die N···H-O Brücke intakt erhalten;
diese Reaktionswege umgehen die spiegelsymmetrische
Konformation, in der der durch die Wasserstoffbrücke geschlossene Ring
planar wird, sondern bleiben von Anfang bis Ende chiral.
Dieses Verhalten findet man bei den Aminosäuren in der Potenzialfäche
des nächsten Homologen,
-Aminoalkoholen betrifft die Anzahl
und die Geometrie der Konformere mit N···H-O
Wasserstoffbrücke. Sowohl
2-Aminoethanol als auch Glycin bilden je ein symmetrie-eindeutiges
Konformer; dieses ist im ersteren Fall asymmetrisch, aber de facto
symmetrisch im zweiteren. Die Potenzialfläche von 2-Aminoethanol
enthält zwei energetisch äquivalente Reaktionswege, die das
wasserstoffbrückengebundene Konformer mit seinem Enantiomer verbinden
und gleichzeitig die N···H-O Brücke intakt erhalten;
diese Reaktionswege umgehen die spiegelsymmetrische
Konformation, in der der durch die Wasserstoffbrücke geschlossene Ring
planar wird, sondern bleiben von Anfang bis Ende chiral.
Dieses Verhalten findet man bei den Aminosäuren in der Potenzialfäche
des nächsten Homologen, 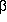 -Alanin, in dem ein sechsgliedriger,
asymmetrischer Ring gebildet wird.
-Alanin, in dem ein sechsgliedriger,
asymmetrischer Ring gebildet wird.
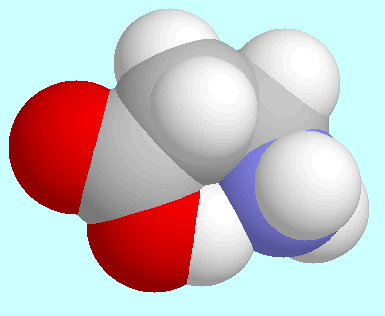 Ein entscheidender Unterschied besteht jedoch
zwischen diesen beiden Fällen: in
Ein entscheidender Unterschied besteht jedoch
zwischen diesen beiden Fällen: in 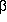 -Alanin sind die
wasserstoffbrückenerhaltenden Reaktionen diejenigen mit der
geringsten Potenzialbarriere, in 2-Aminoethanol sind sie es nicht.
Ganz analog zeigt 3-Aminopropanol ein ähnliches Bild wie
-Alanin sind die
wasserstoffbrückenerhaltenden Reaktionen diejenigen mit der
geringsten Potenzialbarriere, in 2-Aminoethanol sind sie es nicht.
Ganz analog zeigt 3-Aminopropanol ein ähnliches Bild wie
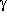 -Aminobuttersäure: zwei Paare
von N···H-O-gebundenen Enantiomeren (A/a und B/b), die
durch einen Zyklus von wasserstoffbrückenerhaltenden Reaktionen
A-B-a-b-A. miteinander verbunden sind.
Auch in diesem Fall sind diese Reaktionen für die Aminosäure die
energetisch günstigsten,
nicht aber für den Aminoalkohol.
-Aminobuttersäure: zwei Paare
von N···H-O-gebundenen Enantiomeren (A/a und B/b), die
durch einen Zyklus von wasserstoffbrückenerhaltenden Reaktionen
A-B-a-b-A. miteinander verbunden sind.
Auch in diesem Fall sind diese Reaktionen für die Aminosäure die
energetisch günstigsten,
nicht aber für den Aminoalkohol.
Der Vergleich von 3-Aminopropanol,
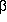 -Alanin und
3-Aminopropanal führt zur Schlussfolgerung,
dass die N···H-O-Wasserstoffbrücken, trotzdem
sie weit stärker sind
als alle anderen Wasserstoffbrücken in diesen Systemen, nicht
den größten Einfluss auf die Potenzialflächen haben.
Statt dessen ist die Gegenwart einer C=O-Gruppe der entscheidende Faktor.
Der oben gegebene Vergleich zwischen Aminoalkoholen und Aminosäuren
führt zum gleichen Schluss: die C=O-Gruppe erzwingt die de facto
planare Anordnung des Molekülgerüsts in Glycin, die
kein Enantiomerenpaar, das durch chirale Reaktionswege verbunden ist,
zulässt. Dazu ist ein zusätzliches Kohlenstoffatom notwendig,
sodass der C
-Alanin und
3-Aminopropanal führt zur Schlussfolgerung,
dass die N···H-O-Wasserstoffbrücken, trotzdem
sie weit stärker sind
als alle anderen Wasserstoffbrücken in diesen Systemen, nicht
den größten Einfluss auf die Potenzialflächen haben.
Statt dessen ist die Gegenwart einer C=O-Gruppe der entscheidende Faktor.
Der oben gegebene Vergleich zwischen Aminoalkoholen und Aminosäuren
führt zum gleichen Schluss: die C=O-Gruppe erzwingt die de facto
planare Anordnung des Molekülgerüsts in Glycin, die
kein Enantiomerenpaar, das durch chirale Reaktionswege verbunden ist,
zulässt. Dazu ist ein zusätzliches Kohlenstoffatom notwendig,
sodass der C -Aminoalkohol der C
-Aminoalkohol der C -Aminosäure
äquivalent wird, und der C
-Aminosäure
äquivalent wird, und der C -Aminoalkohol der C
-Aminoalkohol der C -Aminosäure.
Diese Äquivalenz hinsichtlich der Anzahl der Konformere und
Reaktionswege mit N···H-O-Wasserstoffbrücke
ist jedoch durch die
unterschiedliche Stärke dieser Brücke limitiert:
der C
-Aminosäure.
Diese Äquivalenz hinsichtlich der Anzahl der Konformere und
Reaktionswege mit N···H-O-Wasserstoffbrücke
ist jedoch durch die
unterschiedliche Stärke dieser Brücke limitiert:
der C -Aminoalkohol, in dem diese Brücke relativ am
stärksten ist, ist nicht mehr äquivalent zur C
-Aminoalkohol, in dem diese Brücke relativ am
stärksten ist, ist nicht mehr äquivalent zur C -Aminosäure.
Die unterschiedliche Stärke der
N···H-O-Wasserstoffbrücke ist
wiederum eine Konsequenz der C=O-Gruppe: sie macht das Wasserstoffatom
der O-H-Gruppe stärker positiv als in den Alkoholen und dadurch
die Wasserstoffbrücke stärker.
-Aminosäure.
Die unterschiedliche Stärke der
N···H-O-Wasserstoffbrücke ist
wiederum eine Konsequenz der C=O-Gruppe: sie macht das Wasserstoffatom
der O-H-Gruppe stärker positiv als in den Alkoholen und dadurch
die Wasserstoffbrücke stärker.
![]()
![]() 5-Aminopentanol.
5-Aminopentanol.
© Publikationen
(unsere eigenen).