Intramolekulare Wasserstoffbrücken in Aminoamiden.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Aminoamiden. |
|
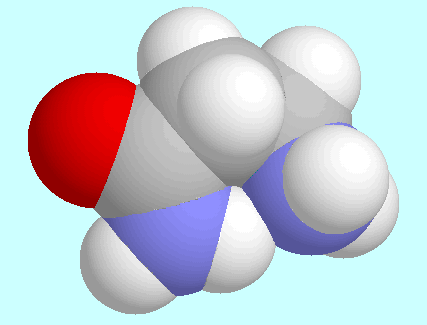
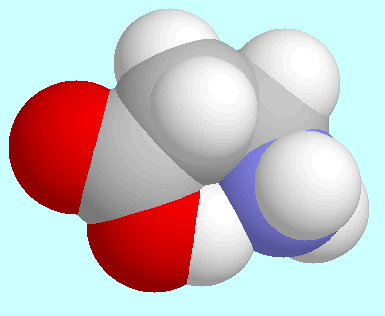 Ein offenkundiger Unterschied der beiden
Konformere von 3-Aminopropionamid
und
Ein offenkundiger Unterschied der beiden
Konformere von 3-Aminopropionamid
und 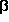 -Alanin mit der O-H···N-Brücke
ist, dass ersteres das globale Minimum
der Potenzialfäche ist, letzteres aber nicht. Das ist auf die
energetisch ungünstige trans-Orientierung der COOH-Gruppe
zurückzuführen, die für
-Alanin mit der O-H···N-Brücke
ist, dass ersteres das globale Minimum
der Potenzialfäche ist, letzteres aber nicht. Das ist auf die
energetisch ungünstige trans-Orientierung der COOH-Gruppe
zurückzuführen, die für 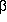 -Alanin eine
Voraussetzung zur Bildung der Wasserstoffbrücke ist; die
dafür nötige Energie wird durch die Wasserstoffbrücke
nur zum Teil wettgemacht. Dagegen hat die CONH
-Alanin eine
Voraussetzung zur Bildung der Wasserstoffbrücke ist; die
dafür nötige Energie wird durch die Wasserstoffbrücke
nur zum Teil wettgemacht. Dagegen hat die CONH -Gruppe nur
eine einzige stabile Anordnung, sodass die Stabilisierung durch die
Wasserstoffbrücke voll zum Tragen kommt.
-Gruppe nur
eine einzige stabile Anordnung, sodass die Stabilisierung durch die
Wasserstoffbrücke voll zum Tragen kommt.
Abgesehen von diesem offenkundigen Unterschied ist die Stärke der beiden
H···N-Brücken recht verschieden:
N-H···N in
3-Aminopropionamid hat einen H···N-Abstand von
2,107 Å,
was 78% der Summe der van der Waals Radien entspricht,
O-H···N in 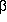 -Alanin hat dagegen einen H···N-Abstand von
1,864 Å (69%).
Auch wird die H-N-Bindung in 3-Aminopropionamid
nur um 0.006 Å verlängert,
die O-H-Bindung in
-Alanin hat dagegen einen H···N-Abstand von
1,864 Å (69%).
Auch wird die H-N-Bindung in 3-Aminopropionamid
nur um 0.006 Å verlängert,
die O-H-Bindung in 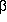 -Alanin aber um 0,017 Å;
die kleinste Potenzialbarriere der jeweiligen Konformere beträgt
12,1 kJ/mol im Aminoamid und 28,7 kJ/mol in der Aminosäure.
-Alanin aber um 0,017 Å;
die kleinste Potenzialbarriere der jeweiligen Konformere beträgt
12,1 kJ/mol im Aminoamid und 28,7 kJ/mol in der Aminosäure.
 Auch ein Vergleich der Torsion der COR-Gruppe in den gestreckten
Konformeren zeigt große Unterschiede. Im Fall von
3-Aminopropionamid führt der Reaktionsweg über einen einzigen
Übergangszustand nach einer Drehung von 180° zurück zum
Ausgangskonformer. Für
Auch ein Vergleich der Torsion der COR-Gruppe in den gestreckten
Konformeren zeigt große Unterschiede. Im Fall von
3-Aminopropionamid führt der Reaktionsweg über einen einzigen
Übergangszustand nach einer Drehung von 180° zurück zum
Ausgangskonformer. Für 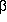 -Alanin mit der sterisch vergleichbaren
trans-Anordnung der COOH-Gruppe werden dagegen sowohl für
die symmetrische als auch für die asymmterische Stellung der Aminogruppe
jeweils drei Konformere entlang dieser Reaktion gebildet. Für die
symmetrische Anordnung der Aminogruppe sind diese Konformere entlang
einer vollen Umdrehung der COOH-Gruppe nach diesem Absatz abgebildet.
Dieser Unterschied ist nicht einfach auf sterische Faktoren
zurückzuführen, denn die Änderungen der relevanten Winkel
sind bis auf Bruchteile eines Grades ident: in der spiegelsymmetrischen
Form von 3-Aminopropionamid beträgt beispielweise der
Winkel C-C-N 115,74°, im entsprechenden Übergangszustand
118,22°; in den
-Alanin mit der sterisch vergleichbaren
trans-Anordnung der COOH-Gruppe werden dagegen sowohl für
die symmetrische als auch für die asymmterische Stellung der Aminogruppe
jeweils drei Konformere entlang dieser Reaktion gebildet. Für die
symmetrische Anordnung der Aminogruppe sind diese Konformere entlang
einer vollen Umdrehung der COOH-Gruppe nach diesem Absatz abgebildet.
Dieser Unterschied ist nicht einfach auf sterische Faktoren
zurückzuführen, denn die Änderungen der relevanten Winkel
sind bis auf Bruchteile eines Grades ident: in der spiegelsymmetrischen
Form von 3-Aminopropionamid beträgt beispielweise der
Winkel C-C-N 115,74°, im entsprechenden Übergangszustand
118,22°; in den 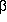 -Alanin-Analogen sind die C-C-O-Winkel 115,77° und 118,39°.
-Alanin-Analogen sind die C-C-O-Winkel 115,77° und 118,39°.

|
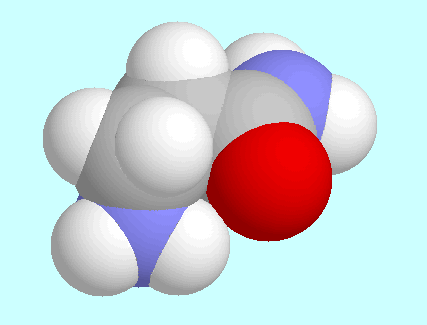
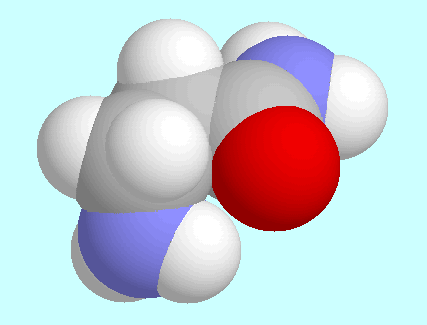 Die zweite intramolekulare Wechselwirkung, N-H···O=C,
ist dagegegen in
3-Aminopropionamid und
Die zweite intramolekulare Wechselwirkung, N-H···O=C,
ist dagegegen in
3-Aminopropionamid und 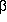 -Alanin nahezu gleich. Sie ist in beiden
Fällen keine Wasserstoffbrücke, sondern von anziehender
elektrostatischer Natur und hat gerade genug Einfluss, um eine
dritte Orientierung der Aminogruppe zu verhindern. Im Falle von
3-Aminopropionamid bewirkt sie zusätzlich eine Kopplung der
Drehungen der beiden funktionellen Gruppen zu einem komplexen
Reaktionsschema mit drei Sattelpunkten zwischen
den beiden Konformeren, die neben diesem Absatz gezeigt sind.
-Alanin nahezu gleich. Sie ist in beiden
Fällen keine Wasserstoffbrücke, sondern von anziehender
elektrostatischer Natur und hat gerade genug Einfluss, um eine
dritte Orientierung der Aminogruppe zu verhindern. Im Falle von
3-Aminopropionamid bewirkt sie zusätzlich eine Kopplung der
Drehungen der beiden funktionellen Gruppen zu einem komplexen
Reaktionsschema mit drei Sattelpunkten zwischen
den beiden Konformeren, die neben diesem Absatz gezeigt sind.