Intramolekulare Wasserstoffbrücken in Aminoamiden.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Aminoamiden. |
|
Die ab initio Ergebnisse, die auf dieser Tour präsentiert wurden, lassen sich wie folgt zusammenfassen:
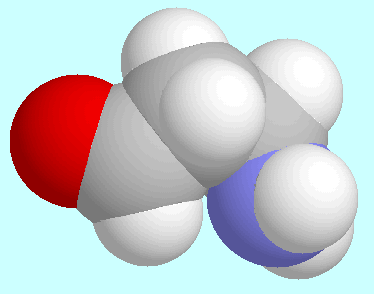 Die Anwesenheit einer C=O-Gruppe hat mehr Einfluss auf die Struktur
als alle intramolekularen Wasserstoffbrücken.
Die Anwesenheit einer C=O-Gruppe hat mehr Einfluss auf die Struktur
als alle intramolekularen Wasserstoffbrücken.
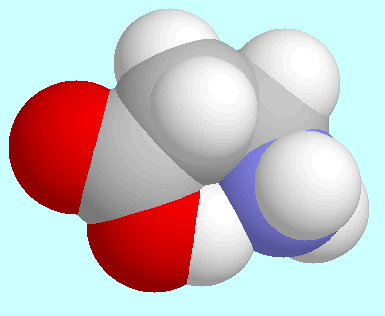 Die stärkste intramolekulare Wasserstoffbrückenbindung in den
untersuchten Verbindungen ist OC-O-H···N in den
Die stärkste intramolekulare Wasserstoffbrückenbindung in den
untersuchten Verbindungen ist OC-O-H···N in den
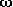 -Aminosäuren;
diese Bindung ist
-Aminosäuren;
diese Bindung ist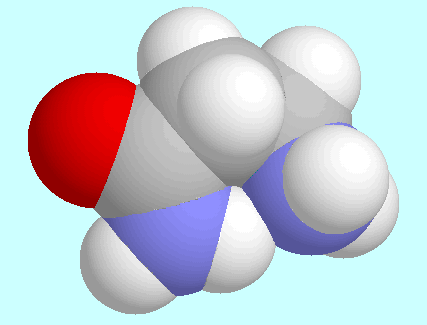 stärker als die entsprechende
OC-N-H···N-Bindung in
stärker als die entsprechende
OC-N-H···N-Bindung in
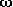 -Aminoamiden,
-Aminoamiden,
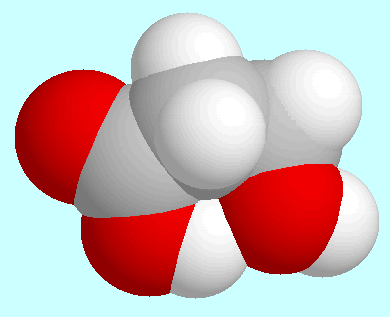 stärker als die entsprechende Bindung
CO-O-H···O in
stärker als die entsprechende Bindung
CO-O-H···O in
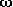 -Hydroxysäuren und
-Hydroxysäuren und
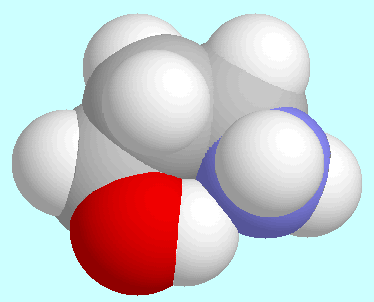 stärker als die entsprechende Bindung
stärker als die entsprechende Bindung
 C-O-H···N
C-O-H···N -Amino-n-alkanolen.
-Amino-n-alkanolen.
 Die CO-O-H···N-Wasserstoffbrücke hat in
den
Die CO-O-H···N-Wasserstoffbrücke hat in
den  -Aminosäuren keine nennenswerte Konkurrenz:
die anderen Wechselwirkungen zwischen den beiden funktionellen Gruppen,
N-H···O=C und N-H···O-C=O,
sind schwach und in den meisten Fällen keine Wasserstoffbrücken.
-Aminosäuren keine nennenswerte Konkurrenz:
die anderen Wechselwirkungen zwischen den beiden funktionellen Gruppen,
N-H···O=C und N-H···O-C=O,
sind schwach und in den meisten Fällen keine Wasserstoffbrücken.
 Im Gegensatz dazu sind die entsprechenden Wechselwirkungen
O-H···O=C und O-H···O-C=O in
Im Gegensatz dazu sind die entsprechenden Wechselwirkungen
O-H···O=C und O-H···O-C=O in
 -Hydroxysäuren stärker und bildet
in vielen Fällen echte Wasserstoffbrückenbindungen.
-Hydroxysäuren stärker und bildet
in vielen Fällen echte Wasserstoffbrückenbindungen.
 In 3-Aminopropionamid sind die gestreckten
Formen bemerkenswert, weil die Rotation der
In 3-Aminopropionamid sind die gestreckten
Formen bemerkenswert, weil die Rotation der  -Gruppe
-Gruppe -Alanin zeigt,
dass sterische Faktoren als Ursache für dieses eher seltene
Energieprofil ausgeschlossen werden können.
-Alanin zeigt,
dass sterische Faktoren als Ursache für dieses eher seltene
Energieprofil ausgeschlossen werden können.
Die ersten drei Punkte dieser Zusammenfassung zeigen eindrucksvoll die
Einzigartigkeit von Aminosäuren. Das gilt nicht nur für
die Wechselwirkungen in den Gasphasenstrukuren, sondern auch in Lösung:
im lebenden Organismus sind  -Aminosäuren die Bausteine für
Proteine und Peptide; es gibt z.B. aber keine Polyester von vergleichbarer
biologischer Bedeutung. (Einige Polyesteranaloge von Peptiden sind
sogar biologisch abbaubar.)
Auch bilden nur Aminosäuren Zwitterionen; die stabile
Wasserstoffbrücke N···H-O-CO, die in der Gasphase
keinerlei
Konkurrenz hat, ist ein Ausgangspunkt zur Ausbildung dieser Zwitterionen,
die daraus ganz ohne externe Protonendonatoren gebildet werden können.
-Aminosäuren die Bausteine für
Proteine und Peptide; es gibt z.B. aber keine Polyester von vergleichbarer
biologischer Bedeutung. (Einige Polyesteranaloge von Peptiden sind
sogar biologisch abbaubar.)
Auch bilden nur Aminosäuren Zwitterionen; die stabile
Wasserstoffbrücke N···H-O-CO, die in der Gasphase
keinerlei
Konkurrenz hat, ist ein Ausgangspunkt zur Ausbildung dieser Zwitterionen,
die daraus ganz ohne externe Protonendonatoren gebildet werden können.
Auch der letzte Punkt der obigen Zusammenfassung hat eine interessante
Verbindung zur Peptid- und Proteinchemie, denn er kann nur dadurch
erklärt werden, dass die gestreckte Form des Fragmentes
 -CO-NH-
-CO-NH- Eine wiederholte Anordnung von substituierten Analoga
genau dieses Fragmentes in genau dieser
Anordnung bildet die "sheet"-Struktur der Proteine und Peptide.
Im Modelltripeptid
Eine wiederholte Anordnung von substituierten Analoga
genau dieses Fragmentes in genau dieser
Anordnung bildet die "sheet"-Struktur der Proteine und Peptide.
Im Modelltripeptid 
 -Alanin.
-Alanin.