Intramolekulare Wasserstoffbrücken in Hydroxysäuren.
 |
English version. |
| © |
Copyright-Hinweis. |
 |
Übersicht. |
Intramolekulare Wasserstoffbrücken in Hydroxysäuren. |
|
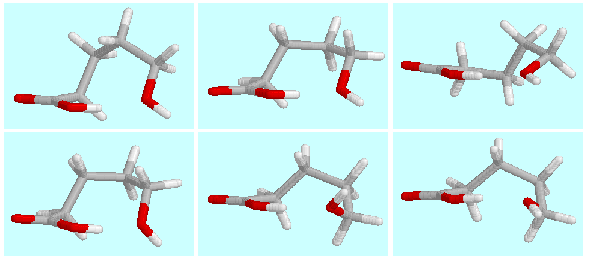
Die Potenzialfäche von  -Hydroxypentansäure
enthält sechs symmetrie-eindeutige Energieminima mit einer
Wasserstoffbrücke (CO)O-H···O-H.
Die Geometrien dieser Minima (A, B, ... F) sind
über diesem Absatz in der Reihenfolge ihrer Energie gezeigt.
Sie sind untereinander und mit den Enantiomeren (a, b, ..., f) durch
die unten dargestellten
wasserstoffbrückenerhaltenden Reaktionen verbunden.
-Hydroxypentansäure
enthält sechs symmetrie-eindeutige Energieminima mit einer
Wasserstoffbrücke (CO)O-H···O-H.
Die Geometrien dieser Minima (A, B, ... F) sind
über diesem Absatz in der Reihenfolge ihrer Energie gezeigt.
Sie sind untereinander und mit den Enantiomeren (a, b, ..., f) durch
die unten dargestellten
wasserstoffbrückenerhaltenden Reaktionen verbunden.
Zwei Reaktionen verdienen insoferne
besondere Beachtung, als sie sehr geringe Potenzialbarrieren haben.
In der ersten Reaktion, D zu B, beträgt diese nur
0,16 kJ/mol. D und B unterscheiden sich nur durch die Anordnung
der aliphatischen OH-Gruppe und haben eine Energiedifferenz von
1,23 kJ/mol. Die harmonische, unskalierte Schwingungswellenzahl der
OH-Rotation in D (211,24 cm ) entspricht einer
Nullpunktsschwingungenergie von 1,27 kJ/mol. Dieser Wert übersteigt
jenen der Potenzialbarriere ganz klar, sodass D kein
stabiles Konformer ist, obwohl es ein echtes lokales Minimum
der Potenzialfläche ist. Die Situation von E und F ist ähnlich:
auch diese Minima unterscheiden sich nur in der Anordnung der OH-Gruppe,
F hat eine Barriere von 1,03 kJ/mol in der Reaktion zu E, aber
für die dieser Reaktion entsprechende Schwingung (295,54 cm
) entspricht einer
Nullpunktsschwingungenergie von 1,27 kJ/mol. Dieser Wert übersteigt
jenen der Potenzialbarriere ganz klar, sodass D kein
stabiles Konformer ist, obwohl es ein echtes lokales Minimum
der Potenzialfläche ist. Die Situation von E und F ist ähnlich:
auch diese Minima unterscheiden sich nur in der Anordnung der OH-Gruppe,
F hat eine Barriere von 1,03 kJ/mol in der Reaktion zu E, aber
für die dieser Reaktion entsprechende Schwingung (295,54 cm )
eine Nullpunktsschwingungsenergie von 1,77 kJ/mol.
Daher gilt für F die gleiche Schlussfolgerung.
)
eine Nullpunktsschwingungsenergie von 1,77 kJ/mol.
Daher gilt für F die gleiche Schlussfolgerung.
Ganz im Gegensatz zu diesen Instiabilitäten ist das Konformer A von beachtlicher Stabilität, was sich nicht nur an der großen Energielücke zwischen A und B (11,62 kJ/mol) zeigt, sondern auch an der Energiebarrieren sowohl für wasserstoffbrückenbrechende (39,5-50,1 kJ/mol) als auch -erhaltende Reaktionen (28,4-44,5 kJ/mol).
Diese Unterschiede in der kinetischen Stabilität sind umso erstaunlicher,
als alle sechs Energieminima ein sehr einheitliches Bild hinsichtlich der
Bindungslängen geben: der
O···H-Abstand liegt zwischen 65% und 68%
der Summe der van der Waals Radien, und die Bildung der Wasserstoffbrücke
führt in allen Fällen zu Verlängerungen der sauren und der
aliphatischen O-H-Bindung von 0,011-0,013 Å (1,2-1,3%) bzw. 0,007-0,012 Å (0,5-0,8%).
Ähnlich wie in
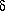 -Aminopentansäure
-Aminopentansäure
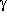 -Hydroxybuttersäure.
-Hydroxybuttersäure.